
- English
- Español
- Português
- русский
- Français
- 日本語
- Deutsch
- tiếng Việt
- Italiano
- Nederlands
- ภาษาไทย
- Polski
- 한국어
- Svenska
- magyar
- Malay
- বাংলা ভাষার
- Dansk
- Suomi
- हिन्दी
- Pilipino
- Türkçe
- Gaeilge
- العربية
- Indonesia
- Norsk
- تمل
- český
- ελληνικά
- український
- Javanese
- فارسی
- தமிழ்
- తెలుగు
- नेपाली
- Burmese
- български
- ລາວ
- Latine
- Қазақша
- Euskal
- Azərbaycan
- Slovenský jazyk
- Македонски
- Lietuvos
- Eesti Keel
- Română
- Slovenski
- मराठी
- Srpski језик
Fabricación de obleas
2025-01-10
A medida que avanza la tecnología, la demanda deobleassigue aumentando. Actualmente, los tamaños principales de obleas de silicio en el mercado nacional son 100 mm, 150 mm y 200 mm. Aumentar el diámetro del silicio.obleaspuede reducir el costo de fabricación de cada chip, lo que genera una demanda creciente de obleas de silicio de 300 mm. Sin embargo, los diámetros más grandes también imponen requisitos más estrictos en parámetros clave, como la planitud de la superficie de la oblea, el control de trazas de impurezas, los defectos internos y el contenido de oxígeno. En consecuencia, la fabricación de obleas se ha convertido en un foco principal de investigación en la producción de chips.

Antes de profundizar en la fabricación de obleas, es fundamental comprender la estructura cristalina subyacente.
La diferencia en la organización atómica interna de los materiales es un factor crucial para distinguirlos. Los materiales cristalinos, como el silicio y el germanio, tienen átomos dispuestos en una estructura periódica fija, mientras que los materiales no cristalinos, como los plásticos, carecen de esta disposición ordenada. El silicio se ha convertido en el material principal para las obleas debido a su estructura única, propiedades químicas favorables, abundancia natural y otras ventajas.
Los materiales cristalinos poseen dos niveles de organización atómica. El primer nivel es la estructura de los átomos individuales, formando una celda unitaria que se repite periódicamente en todo el cristal. El segundo nivel se refiere a la disposición general de estas celdas unitarias, conocida como estructura reticular, donde los átomos ocupan posiciones específicas dentro de la red. El número de átomos en la celda unitaria, sus posiciones relativas y la energía de enlace entre ellos determinan las diversas propiedades del material. La estructura cristalina de silicio se clasifica como una estructura de diamante, compuesta por dos conjuntos de redes cúbicas centradas en las caras desplazadas a lo largo de la diagonal por un cuarto de la longitud de la diagonal.
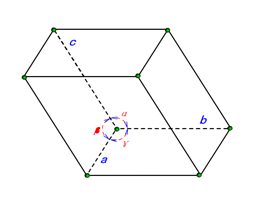
Las características de periodicidad y simetría en los cristales requieren un método más simple para describir las posiciones de los átomos en lugar de utilizar un sistema de coordenadas rectangular tridimensional universal. Para describir mejor la distribución atómica en un cristal en función de su periodicidad reticular, seleccionamos una celda unitaria de acuerdo con tres principios rectores. Esta celda unitaria refleja efectivamente la periodicidad y simetría del cristal y sirve como la unidad repetitiva más pequeña. Una vez determinadas las coordenadas atómicas dentro de la celda unitaria, podemos inferir fácilmente las posiciones relativas de las partículas en todo el cristal. Al establecer un sistema de coordenadas basado en los tres vectores de aristas de la celda unitaria, podemos simplificar significativamente el proceso de descripción de la estructura cristalina.
Un plano cristalino se define como una superficie plana formada por la disposición de átomos, iones o moléculas dentro de un cristal. Por el contrario, la dirección del cristal se refiere a una orientación específica de estos arreglos atómicos.
Los planos cristalinos se representan mediante índices de Miller. Normalmente, los paréntesis () indican planos de cristal, los corchetes [] indican direcciones de cristal, los corchetes angulares <> significan familias de direcciones de cristal y los corchetes {} representan familias de planos de cristal. En la fabricación de semiconductores, los planos cristalinos más utilizados para las obleas de silicio son (100), (110) y (111). Cada plano cristalino posee características únicas, lo que los hace adecuados para diferentes procesos de producción.
Por ejemplo, los planos de cristal (100) se utilizan predominantemente en la fabricación de dispositivos MOS debido a sus propiedades superficiales favorables, que facilitan el control sobre el voltaje umbral. Además, las obleas con (100) planos de cristal son más fáciles de manipular durante el procesamiento y tienen superficies relativamente planas, lo que las hace ideales para producir circuitos integrados a gran escala. Por el contrario, en los dispositivos bipolares se utilizan a menudo planos cristalinos (111), que tienen una mayor densidad atómica y menores costes de crecimiento. Estos planos se pueden lograr manejando cuidadosamente la dirección del cristal durante el proceso de crecimiento seleccionando la dirección apropiada del cristal semilla.
El plano cristalino (100) es paralelo al eje Y-Z y cruza el eje X en el punto donde el valor unitario es 1. El plano cristalino (110) cruza los ejes X e Y, mientras que el plano cristalino (111) cruza los tres ejes: X, Y y Z.
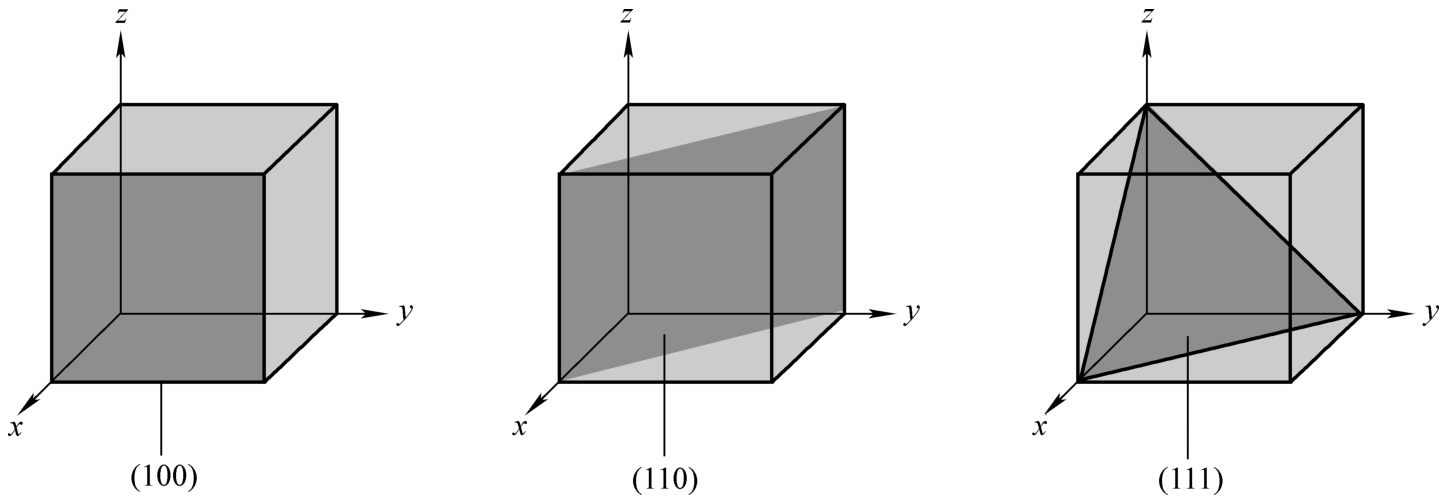
En una perspectiva estructural, el plano cristalino (100) tiene una forma cuadrada, mientras que el plano cristalino (111) adopta una forma triangular. Debido a las variaciones de estructura entre los diferentes planos cristalinos, la forma en que se rompe una oblea también difiere. Las obleas orientadas a lo largo de <100> tienden a romperse en formas cuadradas o crear roturas en ángulos rectos (90°), mientras que las orientadas a lo largo de <111> se rompen en fragmentos triangulares.
Dadas las propiedades químicas, eléctricas y físicas únicas asociadas con las estructuras internas de los cristales, la orientación cristalina específica de una oblea afecta significativamente su rendimiento general. En consecuencia, es crucial mantener un control estricto sobre la orientación de los cristales durante el proceso de preparación.
Semicorex ofrece alta calidadobleas semiconductoras. Si tiene alguna consulta o necesita detalles adicionales, no dude en ponerse en contacto con nosotros.
Teléfono de contacto # +86-13567891907
Correo electrónico: sales@semicorex.com




